Pastila pentru tratarea sclerozei multiple a primit undă verde la Bruxelles
 Comisia Europeană (CE) a acordat autorizația de introducere pe piață pentru MAVENCLAD® 10 mg (tablete de Cladribină) pentru tratamentul oral al sclerozei multiple recidivante (RMS), anunță grupul farmaceutic german Merck.
Comisia Europeană (CE) a acordat autorizația de introducere pe piață pentru MAVENCLAD® 10 mg (tablete de Cladribină) pentru tratamentul oral al sclerozei multiple recidivante (RMS), anunță grupul farmaceutic german Merck.
În teste, Mavenclad a demonstrat o eficacitate clinică susținută de până la 4 ani, cu un maxim de 20 de zile de tratament pe cale orală, o dată la doi ani. La pacienții cu evoluție crescută a bolii, analizele au demonstrat că MAVENCLAD® a redus rata de recidivă anuală cu 67%, iar riscul de progresie a EDSS confirmat cu 6 luni a crescut cu 82% față de placebo.
Autorizația de comercializare include cele 28 de țări ale Uniunii Europene, Norvegia, Liechtenstein și Islanda. Pacienții vor găsi medicamentul în farmacii din Marea Britanie și Germania chiar în cursul lunii septembrie. Merck intenționează să depună dosare suplimentare pentru aprobarea de reglementare în alte țări, inclusiv în Statele Unite.
Peste 2.700 de pacienți au participat la programul de teste clinice ale medicamentului, în unele cazuri observațiile fiind întinse pe durata a zece ani.
„Este momentul care va schimba modul in care tratează sclerozamultiplă”, a declarat Gavin Giovannoni, profesor de Neurologie la Universitatea Regina Maria din Londra. Mavenclad asigură o terapie selectivă de reconstituire imună (SIRT), printr-o administrare simplificată. Pacienții pot beneficia de tratament pe o perioada mai lungă de timp, fără a fi nevoie să ia continuu medicamente și fără a fi necesară monitorizarea lor permanentă.
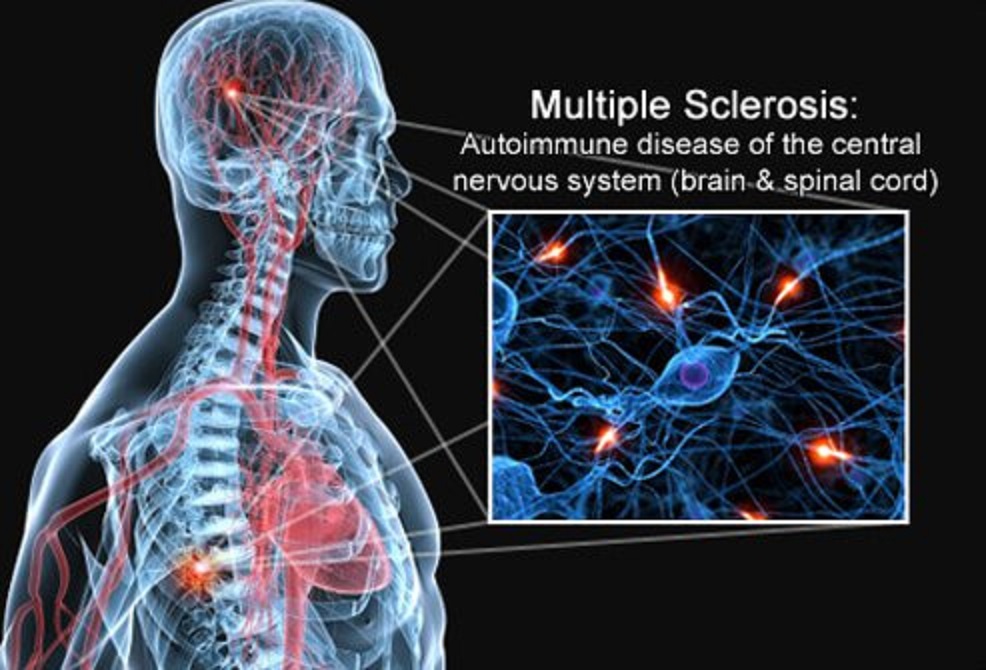
Scleroza multiplă (MS) este una dintre cele mai frecvente tulburări neurologice din lume, afectând mai mult de 700.000 de persoane din întreaga Europă. Până la Mavenclad nu exista un tratament eficient.
![]()

 Engleză
Engleză  Română
Română